Prawne zmiany w pracy z aparaturą medyczną w oparciu o Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2017/745 dotyczące wyrobów medycznych oraz Ustawę o wyrobach medycznych z dnia 7 kwietnia 2022 r. – część 2
 fot. iStock
fot. iStockOstatnie zmiany przepisów związanych z eksploatacją i zarządzaniem aparaturą medyczną wprowadziły nowe wymogi stawiane przed użytkownikiem.
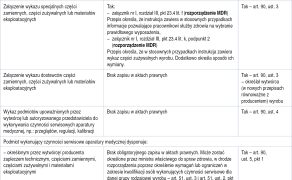
Niniejszy tekst jest kontynuacją artykułu Prawne zmiany w pracy z aparaturą medyczną w oparciu o Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2017/745 dotyczące wyrobów medycznych oraz Ustawę o wyrobach medycznych z dnia 7 kwietnia 2022 r. − cz. 1 opublikowanego na łamach „OPM” 6/2023 (1). Przedstawię w nim minimalne wymagania w zakresie prawidłowego dostarczenia, instalacji, utrzymania i używania aparatury medycznej na podstawie Rozporządzenia Parlamentu Europejskiego i Rady (UE) 2017/745 z dnia 5 kwietnia 2017 roku dotyczącego wyrobów medycznych, zmiany dyrektywy 2001/83/WE, rozporządzenia (WE) nr 178/2002 i rozporządzenia (WE) nr 1223/2009 oraz uchylenia dyrektyw Rady 90/385/EWG i 93/42/EWG (w dalszej części artykułu rozporządzenie MDR) (2) oraz Ustawy z dnia 7 kwietnia 2022 roku o wyrobach medycznych (w dalszej części artykułu ustawa MD) (3). Dodatkowo opiszę przepisy przejściowe i opóźnienia wejścia w życie niektórych przepisów rozporządzenia MDR.
Zmiany w zakresie eksploatacji ...
Dostęp ograniczony.
Pełen dostęp do artykułu tylko dla zalogowanych użytkowników z wykupioną subskrypcją.
Dlaczego warto wykupić subskrypcję?
Otrzymasz dostęp do:- wszystkich merytorycznych publikacji z zakresu nowoczesnych technologii medycznych i zarządzania jednostkami ochrony zdrowia,
- materiałów wideo z wystąpieniami cenionych ekspertów z branży,
- wywiadów z uznanymi praktykami i ekspertami,
- materiałów szkoleniowych z konferencji organizowanych przez "OPM" i dlaSzpitali.pl,
- wydań aktualnych i archiwalnych numerów "OPM" w wersji online