Laboratoryjne metody diagnostyki zakażeń Clostridioides difficile jako ważny aspekt w leczeniu i kontroli CDI
Artykuł opracowały: mgr Emilia Stacherczak, mgr Jolanta Chęcińska, mgr Luiza Sikorska, mgr Karolina Kosowska
Zakład Diagnostyki Laboratoryjnej Szpital Wojewódzki im. Jana Pawła II w Bełchatowie, ul. Czapliniecka 123 97-400 Bełchatów

Zakażenia Clostridioides difficile (CD, CDI) stały się istotnym problemem, z którym zmaga się współczesny system opieki zdrowotnej. Są one najczęściej skutkiem dysbiozy jelitowej, która przybiera różne postacie kliniczne – począwszy od łagodnych biegunek, przez rzekomobłoniaste zapalenie jelit, aż do wystąpienia megacolon toxicum.
C. difficile jest przyczyną 30-50% biegunek poantybiotykowych, co stanowi olbrzymie obciążenie kliniczne i ekonomiczne dla szpitali. Wysokie koszty zakażeń CD mają wymiar zarówno bezpośredni (tj. koszt antybiotykoterapii, operacji, opieki okołooperacyjnej), jak i pośredni wynikający z dłuższej hospitalizacji (o około 1–3 tygodnie), izolacji, kohortacji chorych, dezynfekcji łóżek, pomieszczeń oraz licznymi badaniami dodatkowymi w postaci posiewów, czy też badań genetycznych (rybotypowanie szczepów C. difficile), a niekiedy nawet koniecznością zamknięcia oddziału (1).
Liczba zakażeń C. difficile od 2013 roku, czyli pierwszego roku, gdy zaczęto rejestrować przypadki zakażeń jelitowych CD wynosiła 4 738 przypadków i stale utrzymuje tendencję wzrostową (według danych NIZP-PZH w 2022 roku wynosiła 56,00/100 tys. ludności) (2).
Dlatego też niezwykle ważna jest szybka i precyzyjna diagnostyka CDI, aby można było po pierwsze – wdrożyć odpowiednie leczenie, a po drugie – zminimalizować ryzyko powikłań.
Wprowadzenie
Clostridioides difficile (CD) należy do bezwzględnie beztlenowych Gram (+) bakterii przyjmujących formę laseczek. Ma zdolność ruchu oraz wytwarza przetrwalniki (spory), które mają istotne znaczenie w kontekście chorobotwórczości tego drobnoustroju. Wytwarzanie spor pozwala na przetrwanie w organizmie pacjenta i środowisku zewnętrznym oraz branie udziału w transmisji zakażenia. Spory są oporne na działanie czynników chemicznych i fizycznych takich jak: kwasy, antybiotyki i wysoka temperatura (2).
Zakażenie CD następuje drogą fekalno-oralną. Przeważająca część komórek wegetatywnych ginie w żołądku, natomiast przetrwalniki, które przeżywają w kwaśnym środowisku żołądka, w jelicie cienkim przekształcają się w postacie wegetatywne zdolne do wytwarzania toksyn.
Drobnoustrój ten posiada szereg czynników wirulencji, a do najważniejszych zaliczamy: toksynę A (enterotoksyna – TcdA), toksynę B (cytotoksyna – TcdB), toksynę binarną (CDT – z ang. Clostridium difficile transferase).
CD może wchodzić w skład prawidłowej flory bakteryjnej człowieka, jednak w wyniku zachwiania tej równowagi, na skutek najczęściej stosowania antybiotyku następuje nadmierny rozplem szczepów toksynotwórczych C. difficile i manifestacja objawów klinicznych. Biegunkę powstającą w tym mechanizmie określa się w piśmiennictwie różnymi synonimami (CDI,
C. difficile infection; CDAD, C. difficile associated diarrhea; C. difficile colitis) (1, 3, 4).
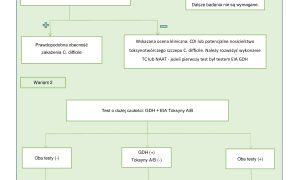
Definicja rozpoznania CDI opiera się na zaobserwowaniu co najmniej jednego z następujących objawów klinicznych:
- biegunka (≥ 3 luźnych stolców dopasowujących się kształtem do pojemnika lub odpowiadających 5-7 w skali Bristol w ciągu 24 h),
- ostre rozdęcie okrężnicy (potwierdzone radiologicznie) bez innej wyraźnej przyczyny,
- niedrożność jelit,
oraz potwierdzenie przynajmniej jednego z poniższych kryteriów:
- stwierdzenie obecności GDH (ang. glutamate dehydrogenas) i toksyn A i/lub B w badanej próbce kału lub wykazanie obecności szczepu toksynotwórczego C. difficile,
- dodatni wynik testu NAAT (ang. nucleic acid amplification tests)
w kierunku obecności genów kodujących toksynę A i/lub B lub toksynę binarną, - rzekomobłoniaste zapalenie jelit uwidocznione w badaniu endoskopowym lub podczas zabiegu operacyjnego czy też w badaniu histopatologicznym (5).
Czytaj też: Rola ferrytyny w magazynowaniu żelaza