Prawne zmiany w pracy z aparaturą medyczną w oparciu o Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2017/745 dotyczące wyrobów medycznych oraz Ustawę o wyrobach medycznych z dnia 7 kwietnia 2022 r. – część 2
Przepisy przejściowe oraz opóźnienie wejścia w życie niektórych przepisów na podstawie rozporządzenia MDR
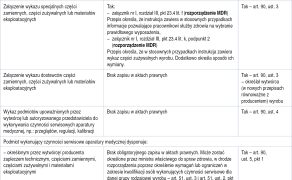
Nie wszystkie przepisy rozporządzenia MDR weszły w życie od 26 maja 2021 roku. Opóźnienia rozpoczęcia ich obowiązywania określa art. 120 – Przepisy przejściowe − oraz art. 123 − Wejście w życie i data rozpoczęcia stosowania. Przepisy przejściowe określają daty wejścia w życie dokumentów potwierdzających przeprowadzenie procedury oceny zgodności wyrobu wydawane na podstawie rozporządzenia MDR. Art. 120 ma kluczowe znaczenie podczas weryfikacji prawidłowości dokumentacji dla danego wyrobu medycznego, np. na etapie sprawdzania ofert przetargowych.
Co do zakresu ważnego pod kątem zarządzania aparaturą medyczną, określa on, że:
- Certyfikaty wydane przez jednostki notyfikowane zgodnie z
dyrektywami 90/385/EWG i 93/42/EWG w okresie od 25.05.2017 r. do
26.05.2021 r. i które nadal były ważne w dniu 26.05.2021 r.
pozostają ważne po zakończeniu okresu wskazanego w certyfikacie
do:
a. 31.12.2027 r. dla wyrobów klasy III i wyrobów do implantacji klasy IIb,
b. 31.12.2028 r. w przypadku wyrobów klasy IIb innych niż wyroby objęte lit. a., IIa oraz I wprowadzonych do obrotu w stanie sterylnym lub klasy I z funkcją pomiarową. - Certyfikaty wydane przez jednostki notyfikowane zgodnie z
dyrektywami 90/385/EWG i 93/42/EWG w okresie od 25.05.2017 r. do
26.05.2021 r. i które nadal były ważne w dniu 26.05.2021 r. i które
utraciły ważność przed dniem 20 marca 2023 r. uznaje się za ważne
do dat określonych w pkt 1 lit. a. oraz b. pod warunkiem:
a. przed datą utraty ważności certyfikatu producent i jednostka notyfikowana podpisali pisemną umowę – dotyczącą oceny...
Dostęp ograniczony.
Pełen dostęp do artykułu tylko dla zalogowanych użytkowników z wykupioną subskrypcją.
Dlaczego warto wykupić subskrypcję?
Otrzymasz dostęp do:- wszystkich merytorycznych publikacji z zakresu nowoczesnych technologii medycznych i zarządzania jednostkami ochrony zdrowia,
- materiałów wideo z wystąpieniami cenionych ekspertów z branży,
- wywiadów z uznanymi praktykami i ekspertami,
- materiałów szkoleniowych z konferencji organizowanych przez "OPM" i dlaSzpitali.pl,
- wydań aktualnych i archiwalnych numerów "OPM" w wersji online