Zmiany prawne w pracy z aparaturą medyczną w oparciu o Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2017/745 dotyczące wyrobów medycznych oraz Ustawę o wyrobach medycznych z dnia 7 kwietnia 2022 r. – część 1

Na przestrzeni ostatnich kilku lat wiele zmieniło się w zakresie przepisów określających wymogi i ograniczenia przy pracy z aparaturą medyczną.
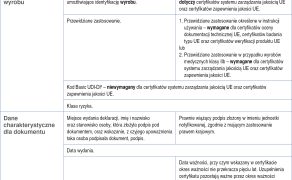
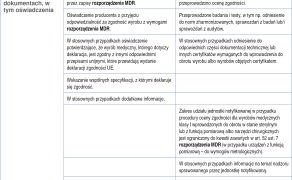
Dla każdego, kto zajmuje się zarządzaniem aparaturą medyczną oraz jej eksploatacją, najważniejszymi aktami prawnymi w codziennej pracy są: Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2017/745 z dnia 5 kwietnia 2017 roku dotyczące wyrobów medycznych zmiany dyrektywy 2001/83/WE, rozporządzenia (WE) nr 178/2002 i rozporządzenia (WE) nr 1223/2009 oraz uchylenia dyrektyw Rady 90/385/EWG i 93/42/EWG (w dalszej części artykułu rozporządzenie MDR) (1) oraz Ustawa z dnia 7 kwietnia 2022 roku o wyrobach medycznych (w dalszej części artykułu ustawa MD) (2). Zapisy zawarte w powyższych dokumentach określają obowiązki oraz wymogi stawiane: wytwórcom, importerom, dystrybutorom, jednostkom zajmującym się kontrolą i nadzorem, użytkownikom, którzy mają na celu ustanowienie wysokich norm jakościowych oraz bezpieczeństwa dla wyrobów medycznych. Zarówno rozporządzenie MDR, jak również ustawa MD porządkują zasady dotyczące wprowadzania do obrotu i do używania wyrobów medycznych. W związku z bardzo szerokim zakresem informacji dotyczącym zarządzania aparaturą medyczną oraz jej eksploatacją, jakie zawierają powyższe akty prawne, w niniejszym artykule opiszę tylko i wyłącznie podstawowe zmiany wprowadzone w pracy z aparaturą medyczną w oparciu o ustawę MD oraz rozporządzenie MDR. Będą one dotyczyły: obszaru stosowania ustawy MD oraz rozporządzenia MDR, dokumentów potwierdzających wprowadzenie do obrotu danego urządzenia jako wyrobu medycznego, systemu niepowtarzalnych kodów identyfikacyjnych wyrobów oraz zmian w zakresie wprowadzania w błąd [...]
Komentarze
Strefa wiedzy
712 praktycznych artykułów - 324 ekspertów - 16 kategorii tematycznych